Валентность и кристаллическая структура
Валентность: Электроны в наружной оболочке, или в валентной оболочке, известны как валентные электроны. Эти валентные электроны определяют химические свойства химических элементов. Именно эти электроны участвуют в химических реакциях с другими элементами. Чрезмерно упрощенное правило химии, применимое для простых реакций, заключается в том, что атомы пытаются сформировать полную внешнюю оболочки из 8 электронов (два для K-оболочки). Атомы могут отдать несколько электронов, чтобы обнажить полную оболочку, находящуюся ниже. Атомы могут принять несколько электронов, чтобы заполнить внешнюю оболочку. Эти два процесса образуют ионы из атомов. Атомы даже могут разделить электроны между собой в попытке заполнить внешнюю оболочку. Этот процесс связывает атомы с образованием молекулы.
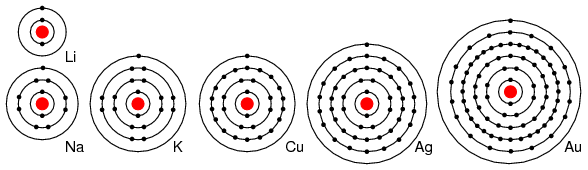
Например, элементы группы I (Li, Na, K, Ag и Au) содержат один валентный электрон (рисунок ниже). Все эти элементы обладают схожими химическими свойствами. Их атомы легко отдают один электрон для взаимодействия с другими элементами. Возможность легко отдать электрон делает эти элементы отличными проводниками.
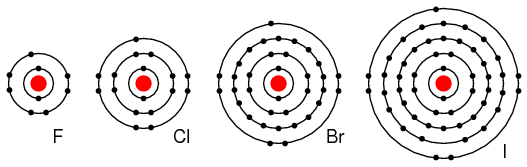
Элементы группы VIIA (F, Cl, Br и I)) содержат 7 электронов на внешней оболочке. Эти элементы легко принимают электрон, чтобы заполнить внешнюю оболочку до полных 8 электронов (рисунок ниже). Если эти элементы примут электрон, из нейтрального атома сформируется отрицательный ион. Эти элементы, не отдающие электронов, являются диэлектриками.
Например, атом Cl принимает электрон от атома Na, чтобы стать ионом Cl-, как показано на рисунке ниже. Ион – это заряженная частица, образующаяся из атома при отдаче или принятии электрона. Так как атом Na отдает электрон, он становится ионом Na+. Это, как атомы Na и Cl объединяются в NaCl, поваренную соль, которая на самом деле является парой ионов, Na+ и Cl-. Na+ и Cl- переносят противоположные заряды и поэтому притягиваются друг к другу.
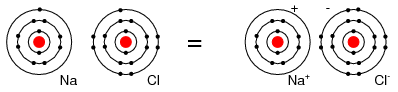
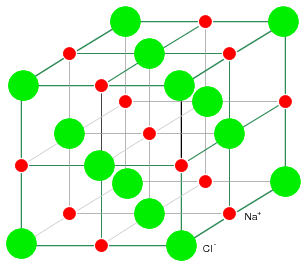
Хлорид натрия кристаллизуется в кубическую структуру, показанную на рисунке ниже. Эта модель изображена не в масштабе, чтобы показать трехмерную структуру. Ионы Na+Cl- фактически упакованы в структуру, похожую на слои сложенных стеклянных шариков. Просто нарисованная кубическая кристаллическая структура показывает, что твердый кристалл может содержать заряженные частицы.
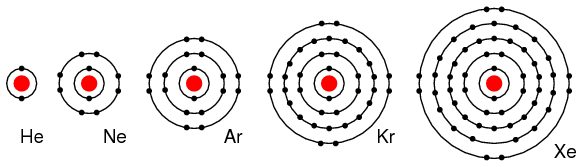
Элементы группы VIIIA (He, Ne, Ar, Kr, Xe) содержат 8 электронов в валентной оболочке (рисунок ниже). То есть, валентная оболочка заполнена, что означает, что эти элементы ни отдают, ни принимают электроны. Они также не вступают легко в реакцию с другими элементами; элементы, начиная с группы VIIIA, не так легко объединяются с другими элементами. В последние годы химики заставили Xe и Kr сформировать несколько соединений, но для нашего обсуждения это не важно. Эти элементы являются хорошими электрическими диэлектриками и газами при комнатной температуре.
Элементы группы IVA (C, Si, Ge), имеющие 4 электрона в валентной оболочке, как показано на рисунке ниже, формируют соединения путем деления электронов с другими элементами без образования ионов. Это связывание общим электроном известно, как ковалентная связь. Обратите внимание, что центральный атом (и другие расширения) имеет заполненную валентную оболочку путем деления электронами. Обратите внимание, что на рисунке приведено 2D представление связи, которая на самом деле является трехмерной. Именно эта группа, IVA, интересна нам своими полупроводниковыми свойствами.
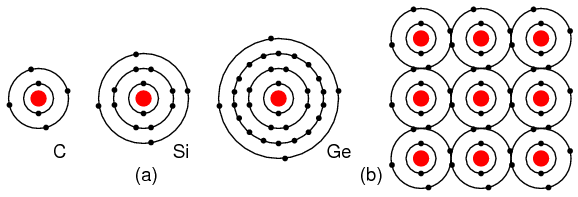
(b) заполнение валентной оболочки путем обмена электронами с другими элементами.
Кристаллическая структура: Большинство неорганических веществ выстраивают свои атомы (или ионы) в упорядоченный массив, известный как кристалл. Наружные облака электронов атомов взаимодействуют упорядоченным способом. Даже металлы на микроскопическом уровне состоят из кристаллов. Если образец металла подвергнуть оптическому шлифованию, затем травлению кислотой, то можно будет увидеть микроскопическую микрокристаллическую структуру, показанную на рисунке ниже. Кроме того, у специализированных поставщиков можно приобрести, при значительных затратах, металлические монокристаллические образцы. Шлифование и травление такого образца не раскрывает микрокристаллической структуры. Практически все промышленные металлы являются поликристаллическими. Большинство современных полупроводников, наоборот, монокристаллические устройства. Нам в первую очередь интересны монокристаллические структуры.
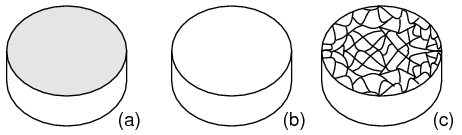
Многие металлы являются мягкими и легко деформируются при использовании различных технологий обработки металлов. При обработке микрокристаллы также деформируются. Кроме того, валентные электроны могут свободно перемещаться по кристаллической решетке и от кристалла к кристаллу. Валентные электроны принадлежат всем атомам, а не какому-либо конкретному атому.
Твердая кристаллическая структура, приведенная на рисунке ниже, состоит из постоянно повторяющегося шаблона из положительных ионов Na и отрицательных ионов Cl. Атомы Na и CL образуют ионы Na+ и Cl- путем передачи электрона от Na к Cl без образования свободных электронов. В отличие от металла, здесь электроны не могут свободно передвигаться по кристаллической решетке. Ионы также не свободны. Ионы зафиксированы на месте в кристаллической структуре. Хотя ионы смогут свободно перемещаться, если кристалл NaCl будет растворен в воде. Однако, кристалл уже не будет существовать, а повторяющаяся структура будет утеряна. Выпаривание воды даст осадок ионов Na+ и Cl- в форме новых кристаллов, так как противоположно заряженные ионы притягиваются друг к другу. Ионные материалы образуют кристаллические структуры благодаря сильному электростатическому притяжению противоположно заряженных ионов.
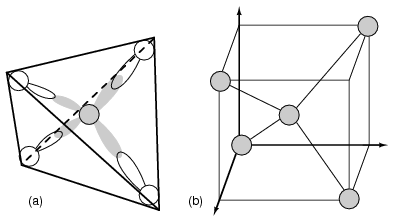
Полупроводники группы 14 (ранее часть группы IV) образуют шаблон четырехгранного сцепления, использующий электроны s и p орбиталей атома, деля электронные парные связи с четырьмя соседними атомами (рисунок ниже (a)).
Элементы группы 14 содержат четыре внешних электрона: два на сферической s-орбитали и два на p-орбитали. Одна из p-орбиталей свободна. Три p-орбитали скрещиваются с s-орбиталью для образования четырех sp3 молекулярных орбиталей. Эти четырехэлектронные облака отталкиваются друг от друга на равное тетраэдрическое расстояние от атома Si, притягиваемые положительным ядром, как показано на рисунке ниже.
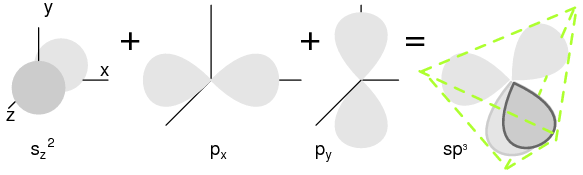
Каждый атом полупроводника, Si, Ge или C (алмаз), химически связан с четырьмя другими атомами ковалентными связями, связями с общими электронами. Два электрона могут делить орбиталь, если каждый из них имеет противоположные спиновые квантовые числа. Таким образом, непарный электрон может делить орбиталь с электроном из другого атома. Это соответствует перекрытию электронных облаков, или связыванию (рисунок ниже(a)).
Рисунок ниже (b) показывает одну четвертую часть ячейки кристаллической структуры алмаза, показанной на рисунке ниже в центре. Связи особенно сильны в алмазе и уменьшаются по силе при движении вниз по группе IV к кремнию и германию. И кремний, и германий формируют кристаллы с алмазной структурой.
Алмазная ячейка является основным строительным блоком кристалла. Рисунок ниже показывает четыре атома (темные), связанных с четырьмя другими внутри ячейки. Это эквивалентно размещению одной структуры, показанной на рисунке выше (b) в центр рисунка ниже, а затем размещению еще трех на смежных гранях, чтобы заполнить весь куб.
Шесть атомов попадают на середину каждой из шести граней куба, показывая две связи. Другие две связи с соседними кубами были пропущены для ясности. Из восьми углов куба четыре атома связаны с с атомами в кубе. А с чем связаны остальные четыре атома? Остальные четыре связи с соседними кубами кристалла. Имейте в виду, что, хотя у четырех угловых атомом не показаны связи в кубе, все атомы в кристалле связаны в одну гигантскую молекулу. Полупроводниковый кристалл строится из копий этой элементарной ячейки.
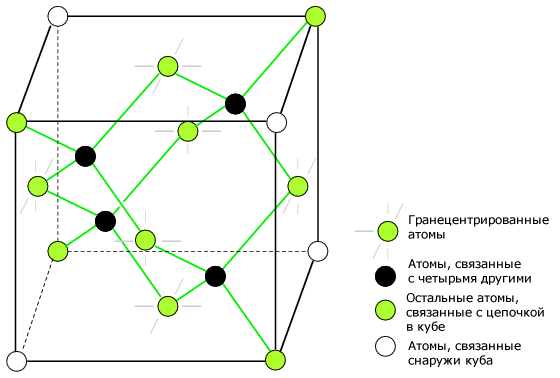
Кристалл является одной молекулой. Атом ковалентно связывается с четырьмя другими, которые в свою очередь связываются с четырьмя атомами, и так далее. Кристаллическая решетка относительно жестко препятствует деформации. Несколько электронов освобождаются для передвижения в кристалле. Основным свойством полупроводников является то, что освободившийся электрон создает положительно заряженное пустое пространство, которое тоже оказывает влияние на проводимость.
Краткие итоги
Атомы пытаются сформировать полную внешнюю, валентную, оболочку из 8 электронов (из 2 электронов для самой внутренней оболочки). Атомы могут отдать несколько электронов, чтобы обнажить нижестоящую оболочку из 8 электронов, и принять несколько электронов, чтобы заполнить оболочку, или делиться электронами, чтобы заполнить оболочку.
Атомы часто формируют упорядоченные массивы из ионов или атомов в жесткой структуре, известной как кристалл.
Нейтральный атом может образовывать положительные ионы, отдавая электроны.
Нейтральный атом может образовывать отрицательные ионы, принимая электроны.
Полупроводники группы IVA (C, Si, Ge) кристаллизуются в алмазную структуру. Каждый атом в кристалле является частью гигантской молекулы, связываясь с четырьмя другими атомами.
Большинство полупроводниковых устройств изготавливаются из монокристаллов.
